Chẩn đoán trước sanh của nhẵn não: Báo cáo một trường hợp
CHẨN ĐOÁN TRƯỚC SANH CỦA NHẴN NÃO: BÁO CÁO MỘT TRƯỜNG HỢP
1Phạm Thị Thùy Dương, 1Trần Công Trình, 1Hà Tố Nguyên1
Khoa Chẩn Đoán Hình Ảnh, Bệnh viện Từ Dũ, Thành phố Hồ Chí Minh
xem file PDF
TÓM TẮT:
Chúng tôi mô tả một trường hợp siêu âm ghi nhận các dấu hiệu bất thường ở một thai nhi 33 – 34 tuần, nghi ngờ nhẵn não đơn độc. Các kết quả siêu âm theo dõi và MRI sau đó cho thấy có đa ối, thai nhỏ so với tuổi thai, dãn não thất hai bên, thiểu sản thể chai. Chọc dò cuống rốn cho kết quả nhiễm sắc thể đồ bình thường, và không mất nhánh ngắn nhiễm sắc thể số 17. Phát hiện sớm tật não nhỏ và các bất thường khác ở sọ có thể là dấu hiệu của nhẵn não đơn độc và cần phải được đánh giá cẩn thận bằng siêu âm và MRI, để phát hiện các bất thường về sự phát triển ở vỏ não thai nhi
Các từ khóa: Nhẵn não; nhẵn não đơn độc, chẩn đoán trước sanh; hội chứng Miller–Dieker; siêu âm; cộng hưởng từ (MRI)
Nhẵn não là một bệnh nặng hiếm gặp liên quan đến bất thường vỏ não do thất bại trong việc di trú tế bào thần kinh ở tháng thứ 3 và thứ 4 của thai kỳ. Hậu quả là không hoặc có rất ít các hồi não, biểu hiện với bề mặt não phẳng, chậm phát triển tâm thần, và động kinh. Các dấu hiệu thường gặp là không hoặc có rất ít hồi não. Các bất thường ở sọ và ngoài sọ thường cũng có thể thấy trong nhẵn não. Tiên lượng của nhẵn não thường nặng, tử vong trong giai đoạn sơ sinh hoặc nhũ nhi; do vậy, chẩn đoán trước sanh giữa vai trò cực kỳ quan trọng trong việc theo dõi thai kỳ.1,2
Về mặt lâm sàng – bệnh học, nhẵn não có hai nhóm.2 Trong nhẵn não nhóm I (nhóm cổ điển), 6 lớp vỏ não bình thường trên mô học được thay thế bởi vỏ não dày bất thường, được tái tạo lại gồm 4 lớp, kèm theo các bất thường về kiểu hình như hội chứng Miller–Dieker hoặc hội chứng Norman–Roberts.3 Trong nhẵn não nhóm II, về mặt bệnh học đặc trưng bởi vỏ não không được tổ chức hóa, mất phân lớp, bao gồm hội chứng Walker–Warburg, với não úng thủy là biểu hiện thường gặp.4 Hai nhóm lâm sàng – bệnh học được đặc trưng bởi các vùng vỏ não dày, dãn các não thất, và kém kém myelin hóa tế bào thần kinh.
Hiện nay, bất thường di trú tế bào thần kinh được chia thành 3 nhóm chính theo phân loại của Barkovich. Nhóm A, còn được gọi là nhẵn não - lạc chỗ chất xám dưới vỏ bao gồm nhẵn não loại I, nhẵn não kèm bất sản thể chai, nhẵn não kèm thiểu sản tiểu não và nhẵn não không phân loại được. Nhóm B, còn được gọi là nhẵn não phức hợp “ cobblestone”, bao gồm nhẵn não loại II. Nhóm C bao gồm các loại lạc chỗ chất xám khác với lạc chỗ chất xám dưới vỏ não.Siêu âm cho phép phát hiện những thay đổi ở vỏ não thai nhi liên quan đến các bất thường ở hồi não ở nhiều giai đoạn trong thai kỳ.5 MRI có ích để phát hiện và xác định những bất thường trong quá trình phát triển của vỏ não.6
Chúng tôi báo cáo một trường hợp chẩn đoán trước sanh nhẵn não đơn độc trên siêu âm độ phân giải cao và cộng hưởng từ (MRI).
BÁO CÁO MỘT TRƯỜNG HỢP
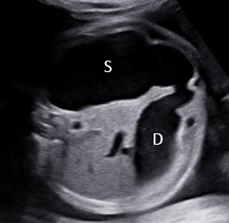
Sản phụ 25 tuổi, con so, quá trình siêu âm và khám thai ở tuyến trước không ghi nhận bất thường, không có bệnh lý nội khoa, không tiền căn sử dụng thuốc. Sản phụ vào viện ở tuổi thai 33 – 34 tuần.Siêu âm được thực hiện trên máy GE Volusion Expert dùng đầu dò 2–7-MHz (GE Healthcare, Milwaukee, WI). Ở tuổi thai 33 – 34 tuần, các tham số sinh trắc học thai kỳ được ghi nhận: chiều dài xương đùi, 59mm; chu vi vòng bụng, 243mm; ước lượng cân thai, 1500g. Đường kính lưỡng đính là 81mm, và chu vi vòng đầu là 295mm, nằm ở bách phân vị 3rd bách phân vị so với tuổi thai, gợi ý tật đầu nhỏ. Các dấu hiệu bất thường trên siêu âm bao gồm đa ối, thai nhỏ so với tuổi thai, dãn não thất bên hai bên và thiểu sản thể chai (Hình 1 và Hình 2). Các xét nghiệm về nhiễm trùng (bao gồm nhóm TORCH) cho kết quả bình thường.
Nhiễm sắc thể đồ trước sanh được thực hiện sau khi bệnh nhân được tư vấn về di truyền. Phân tích nhiễm sắc thể ở thai nhi cho thấy nhiễm sắc thể đồ bình thường 46,XY, và không mất nhánh ngắn của nhiễm sắc thể số 17 (hội chứng Miller–Dieker). Xét nghiệm lai tại chỗ phát huỳnh quang (Fluorescent in situ hybridization – FISH) dùng các đoạn dò S. Orange và S. Green không thấy mất nhánh ngắn của các đoạn sau lai từ nhiễm sắc thể 17p13 (LSI1) và 17.q21.1 (LSI RARA).
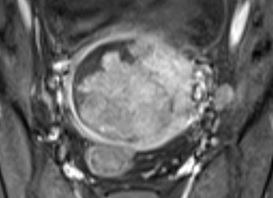
Cộng hưởng từ (MRI) được thực hiện trên hệ thống Siemens 1.5T MAGNETOM Avanto (Siemens Healthcare, Erlangen, Germany) được thực hiện ở tuần 33- 34 của thai kỳ, không tiêm thuốc tương phản, với các chuỗi xung T1WI, T2WI theo các hướng axial, coronal và sagital. MRI ghi nhận các chỉ số sinh trắc học nhỏ so với tuổi thai, dãn não thất, bề mặt não nhẵn, không thấy hồi não và không thấy các rãnh vỏ não bình thường, gợi ý nhẵn não (Hình 3, 4, 5, 6).
 click để xem hình lớn hơn
click để xem hình lớn hơn
Hình 1 và 2: Hình 1. Siêu âm mặt phẳng ngang ở tuần 33 – 34 của thai kỳ cho thấy dãn não thất (mũi tên) và và rãnh Sylvian/đảo dẹt (mũi tên chấm). Hình 2. Siêu âm mặt phẳng đứng dọc cho thấy thể chai (mũi tên) ngắn so với tuổi thai (nguồn: BS. Hà Tố Nguyên, đã được cho phép)
 click để xem hình lớn hơn
click để xem hình lớn hơn
Hình 3 và 4: Hình 3. MRI chuỗi xung T2W trên mặt phẳng ngang cho thấy rãnh Sylvian nông (mũi tên). Hình 4. MRI chuỗi xung T2W trên mặt phẳng trán cho thấy rãnh Sylvian nông (mũi tên)  Click để xem hình lớn hơn
Click để xem hình lớn hơn
Hình 5 và 6: Hình 5. MRI chuỗi xung T2W trên các mặt phẳng trán cho thấy rãnh cựa nông (mũi tên). Hình 6. MRI chuỗi xung T2W trên mặt phẳng trán cho thấy không có rãnh đai (mũi tên)
Sau khi được tư vấn về tiên lượng của thai nhi, sản phụ và gia đình quyết định chấm dứt thai kỳ. Thai nhi được sinh ra có cân nặng 1500g và tử vong ngay sau sanh. Hình ảnh tử thiết của một trường hợp nhẵn não trong y văn cho thấy não nhỏ, hai mặt đóng thấp, mũi ngắn, cằm nhỏ và không có hồi não (Hình 7A và 7B).
 Click để xem hình lớn hơn
Click để xem hình lớn hơn
Hình 7: (A) Tử thiết sau sanh. Hình chụp cho thấy thai nhi bị tật đầu nhỏ, hai mắt gần nhau, mũi ngắn, dày môi trên, tai đóng thấp, và xương hàm nhỏ. (B) Tử thiết sau sanh. Hình chụp cho thấy bề mặt vỏ não của thai nhi nhẵn hoàn toàn (nguồn: Aslan et al.)
THẢO LUẬN
Các yếu tố về môi trường, di truyền, tiền căn gia đình, và nhiều yếu tố khác gây ra loạn sản vỏ não ở nhiều mức độ khác nhau. Mức độ loạn sản vỏ não rất đa dạng. Hiện nay, bệnh nguyên của loạn sản vỏ não vẫn chưa được sáng tỏ.
Các rãnh nguyên phát có thể thấy được ở tuần thứ 19 của thai kỳ, nhưng bề mặt não vẫn nhẵn. Do vậy chẩn đoán chậm phát triển vỏ não không nên nghĩ đến ở trước tuần thứ 20 của thai kỳ. Siêu âm qua ngã âm đạo cho thấy vỏ não tương đối phẳng cho đến tuần thứ 24–25 của thai kỳ. Siêu âm qua ngã bụng sẽ không phát hiện các rãnh vỏ não ở trước tuần 28–30 của thai kỳ; do vậy, chẩn đoán xác định dựa trên các dấu hiệu của siêu âm không thể thực hiện trước tuần 28 của thai kỳ. Lúc đầu, rãnh não chỉ như một chấm nhỏ trên bề mặt não sau đó có dạng chữ V. Cuối cùng rãnh não sâu xuống tạo thành các dấu ấn lõm trên bề mặt não và các đường hồi âm dày dạng chữ Y khi khảo sát bằng siêu âm. Sự phát triển của các rãnh não quan sát được trên siêu âm được minh họa trong Hình 8. Sự hình thành nắp của thùy đảo để tạo nên rãnh Sylvian cũng là một mốc quan trọng để đánh giá nhẵn não. Sự hình thành nắp thùy đảo và tạo nên rãnh Sylvian trên siêu âm được thể hiện trong Hình 9.
Hình 8: Hình minh họa cho thấy sự phát triển bình thường của các rãnh vỏ não từ tuần thứ 18 đến tuần 41 của thai kỳ. Hình vẽ cho thấy sự thay đổi về hình thái trên siêu âm của ranh Sylvian (a), Rãnh đính – chẩm (b), và rãnh cựa (c) trong suốt thai kỳ. w: Tuần
Hình 9: (a) Mặt phẳng chuẩn trên siêu âm để đánh giá sự hình thành nắp thể chai và rãnh Sylvian: sử dụng mặt phẳng cắt ngang qua não thai nhi với ba mốc giái phẫu: bể quanh cuống não (ac), não thất ba (tv) và phần dưới của vách trong suốt ở ngang mức các cột của vòm não (csp). (b) Bảng điểm: đánh giá bán định lượng sự gối lên (overriding) của thùy thái dương đối với thùy đảo, sử dụng thang điểm từ 0 đến 10. Đường ngang là hướng của thùy đảo. Đối với các điểm 0, 1 và 2, góc giữa thùy đảo và thùy thái dương được thể hiện trên hình, đối với thang điểm từ 3–10, đường cong biểu hiện cho thùy thái dương gối lên nửa sau của thùy đảo (4 điểm = nửa sau của thùy đảo bị gối lên 1/4; 6 điểm = bị gối lên 1/2; 8 điểm = bị gối lên 3/4; 10 điểm = bị gối lên hoàn toàn).
Tật đầu nhỏ, thấy trong 16% trường hợp, do thất bại trong quá trình phát triển của hồi não và rãnh não, gây dãn các não thất và bất thường hình dạng của đầu, rất gợi ý đến nhẵn não. 8 Những trường hợp bất thường trên siêu âm cần được đánh giá thêm bằng cộng hưởng từ (MRI).9,10 Trong hầu hết trường hợp, nhẵn não chỉ có thể được phát hiện bằng MRI sau sanh hoặc tử thiết những trường hợp thai lưu hoặc tử vong chu sinh.11
MRI cho ra những hình ảnh rõ nét với bề mặt nhu vỏ não phẳng. 6 Tuy nhiên, nhẵn não đơn độc có thể không phát hiện được nếu MRI được thực hiện quá sớm trong thai kỳ.Sáu gene liên quan đến nhẵn não nhóm I (LIS1, YWHAE, CRK, DCX, RELN, ARX genes, nằm ở vị trí 17p13.3, Xq22.3, 7q22, and Xp22.13) cũng đã được xác định .12–16 Khi siêu âm và MRI phát hiện không có hồi não, có thể xác định hội chứng Miller–Dieker bằng xét nghiệm lai tại chỗ phát huỳnh quang (Fluorescent in situ hybridization – FISH) để phát hiện mất đoạn nhiễm sắc thể 17p13.3.17Hội chứng Miller–Dieker (nhẵn não nhóm I) có thể kèm theo những bất thường khác, chẳng hạn như teo tá tràng, bất thường hệ niệu, bệnh tim bẩm sinh, tinh hoàn lạc chỗ, thoát vị thành bụng, và tật dính ngón.10,17,18 Hội chứng Walker–Warburg (nhẵn não nhóm II) là bất thường nhiễm sắc thể lặn gây tử vong thai nhi, được định nghĩa khi có não úng thủy, mất hồi não, và loạn sản võng mạc có hoặc không thoát vị não, thường kèm theo loạn sản cơ. Tật mắt nhỏ, cườm (glaucoma) bẩm sinh, tật đầu nhỏ, dị dạng Dandy-Walker, và bất sản thể chai cũng có thể gặp. Các bất thường khác kèm theo, chẳng hạn như tật sứt môi và những bất thường hệ sinh dục, cũng được báo cáo10 Trong trường hợp của chúng tôi, không thấy các bất thường ở bụng, hệ sinh dục, hoặc ở tim.
Chúng tôi tin rằng tật đầu nhỏ nặng có thể là dấu hiệu bất thường đầu tiên của loạn sản vỏ não và cần gợi ý đến đơn độc . Siêu âm theo dõi, cộng hưởng từ (MRI) và các xét nghiệm di truyền ở giai đoạn sớm của tam cá nguyệt thứ ba của thai kỳ rất cần thiết để đánh giá sự phát triển các rãnh não ở những thai nhi có tật đầu nhỏ.
MỘT SỐ VIDEO MINH HỌA VỀ TRƯỜNG HỢP NHẴN NÃO
Video 1
Video 2
TÀI LIỆU THAM KHẢO
1. Van der Knapp M, Valk J. Classification of congen ital abnormalities of the CNS. Am J Nucl Radiol 1988;9:315.
2. Dobyns WB, Greenberg F. Syndromes with lissencephaly type I: Miller–Dieker and Norman–Roberts, syndromes and isolated lissencephaly. Am J Med Genet 1984;18:509.
3. Dobyns WB, Truwit CL, Ross ME, et al. Differences in the gyral pattern distinguish chromosome 17-linked and X-linked lissencephaly. Neurology 1999;53:270.
4. Aicardi J. The agyria pachygyria complex: a spectrum of cortical malformations. Brain Dev 1991; 13:1.
5. Greco P, Resta M, Vimercati A, et al. Antenatal diagnosis of isolated lissencephaly by ultrasound and magnetic resonance imaging. Ultrasound Obstet Gynecol 1998;12:276.
6. Okamura K, Murotsuki J, Sakai T, et al. Prenatal diagnosis of lissencephaly by magnetic resonance image. Fetal Diagn Ther 1993;8:56.
7. Monteagudo A, Timor-Tritsch IE. Development of fetal gyri, sulci and fissures: a transvaginal sonographic study. Ultrasound Obstet Gynecol 1997;9:222.
8. Entezami M, Albig M, Gasiorek-Wiens A, Becker R. Selected Syndomes and Associations. In: Entezami M, editor. Ultrasound Diagnosis of Fetal Anomalies. New York: Thieme; 2004, p 282.
9. Comstock CH, Chervenak FA. Transabdominal sonography of the fetal forebrain. In: Kurjak A, editor. Progress in obstetric and gynecological sonography series, ultrasound and the fetal brain. Carnforth, UK: Parthenon Publishing; 1995, p 43.
10. Ghai S, Fong KW, Toi A, et al. Prenatal US and MR imaging findings of lissencephaly: review of fetal cerebral sulcal development. Radiographics 2006;26:389.
11. Breeze AC, Dey PK, Lees CC, et al. Obstetric and neonatal outcomes in apparently isolated mild fetal ventriculomegaly. J Perinat Med 2005;33:236.
12. Kato M, Dobyns WB. Lissencephaly and the molecular basis of neuronal migration. Hum Mol Genet 2003;12:R89.
13. Toyo-oka K, Shionoya A, Gambello MJ, et al. 14–3–3_ is important for neuronal migration by binding to NUDEL: a molecular explanation for Miller-Dieker syndrome. Nat Genet 2003;34:274.
14. Cardoso C, Leventer RJ, Ward HL, et al. Refinement of a 400-kb critical region allows genotypic differentiation between isolated lissencephaly, Miller-Dieker syndrome, and other phenotypes secondary to deletions of 17p13.3. Am J Hum Genet 2003;72: 918.
15. Pilz DT, Matsumoto N, Minnerath S, et al. LIS1 and XLIS (DCX) mutations cause most classical lissencephaly, but different patterns of malformation. Hum Mol Genet 1998;7:2029.
16. des Portes V, Pinard JM, Billuart P, et al. A novel CNS gene required for neuronal migration and involved in X-linked subcortical laminar heterotopias and lissencephaly syndrome. Cell 1998;92:51.
17. Benacerraf BR. Miller-Dieker syndrome. In: Benacerraf BR, editor. Ultrasound of fetal syndromes. Philadelphia, PA: Churchill Livingstone; 1998, p 130.
18. Fong KW, Ghai S, Toi A, et al. Prenatal ultrasound findings of lissencephaly associated with Miller-Dieker syndrome and comparison with pre- and postnatal magnetic resonance imaging. Ultrasound Obstet Gynecol 2004;24:716

.png)